Otros principios inmediatos...
-(dicen que constituyen el 50% del peso seco de los seres vivos)-
-(dicen que constituyen el 50% del peso seco de los seres vivos)-
https://www.ajinomoto.com/cms_wp_ajnmt_global/wp-content
/uploads/aminoacids/png/What_Amino_02-854x584-1.png
... son las proteínas, formadas, a nivel atómico, por Carbono, Hidrógeno, Oxígeno y Nitrógeno, y, en menor proporción, azufre.
Las proteínas son moléculas muy, muy, muy grandes, formadas por otras más pequeñas... los aminoácidos.
Los aminoácidos so moléculas que presentan -¡no podía ser de otro modo!- un grupo amino y otro ácido (=carboxilo).
| http://www.argenbio.org/adc/uploads/imagenes_doc/composicion_ %20delas_%20celulas/aminoacido.JPG |
Los aminoácidos se unen "unos a otros" mediante el denominado (¡¡¡química otra vez!!!) enlace peptídico:
https://1.bp.blogspot.com/-qvL9VUFMh6A/XD4oc9ZA_DI/AAAAAAAABko/l2KlNCGeJDczPFdiW6mL
tv6Bo_WKgtZSgCLcBGAs/s1600/Formaci%25C3%25B3n%2Bde%2Benlace%2Bpept%25C3%25ADdico.png
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiPqDo_Vv0MaLhyphenhyphen-9E4l5nT2ew8R9juxuSGdneVpDHGerovyZAQq NA8z3BYA8hL-mRSUs0YUdvmXCKsK6nSBsT0KXgw2PckUuRqxoXHfyrcCyCuRlYIVKRCIc4kJgyQfLy9I42dCNwTtXY/s320/peptide.gif "Proceso" de "derecha a izquierda". Generalmente "se expresa" de iz. a der. |
Hay veinte (aminoácidos) diferentes... son los "lamados" aminoácidos proteinogénicos (¡los que "constituyen" las proteínas"!)
| http://image.slidesharecdn.com/3a-aminoacidos-proteinas-141011133508-conversion-gate01/95/ aminoacidos-y-protenas-2-bachillerato-ver2014-5-638.jpg?cb=1413052820 |
Cada ser vivo tiene/tenemos sus/nuestras propias proteínas. "A esto" se le denomina especificidad.
Y esa especificidad viene "marcada" por el orden en el que "se colocan" los aminoácidos (dentro de la propia proteína). Esta "disposición específica" se conoce (también) como ESTRUCTURA PRIMARIA de las proteínas.
ESTRUCTURA CUATERNARIA. Únicamente la "adquieren" algunas proteínas. Se generan por la asociación de dos o más estructuras terciarias.
| http://upload.wikimedia.org/wikipedia/commons/thumb/3/38/ Protein_primary_structure.svg/369px-Protein_primary_structure.svg.png |
Pero la estructura de las proteínas es más, bastante más compleja:
 |
| http://3.bp.blogspot.com/-80hpfm2Zrjo/UV8j0wVafWI/ AAAAAAAABu0/EhWy3OXpSPg/s640/enzyme.gif |
ESTRUCTURA SECUNDARIA. Podríamos decir que se trata "de la disposición de la cadena proteíca en el espacio". Entre el grupo carbonilo (que se ha formado en el enlace peptídico) y el grupo amino de aminoácidos próximos, pueden formarse enlaces por puestes de hidrógeno.
Si estas uniones se dan entre aminoácidos de la misma cadena, se forman estructuras helicoidales que, generalmente, reciben el nombre de α hélice.
En otras ocasiones, los puentes de hidrógeno se dan entre cadenas distintas, disponiéndose en estructuras denominadas β laminar.
Por tanto, en la estructura secundaria podemos distinguir entre α hélice y β laminar.
https://madoverchemistry.com/wp-content/uploads/2019/01/1024.jpg
https://cdn.kastatic.org/ka-perseus-images/6c1459b742ced7cb1175cef18b4e2bde9036bb13.png
ESTRUCTURA TERCIARIA. Los aminoácidos tienen cadenas laterales variables -grupos "R" diferentes-, y algunos, cuando se hallan muy próximos en la cadena proteíca (y aunque estuvieran "muy lejos", la "disposición secundaría" podría "habaerlos acercado"), pueden establecer otro tipo de enlaces entre ellos (puente disulfuro, por ejemplo)
https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcRNpD1d1r_Oa_AZjtk1X6N2choBPPRaNX6aXw&s
http://cienciasvirtual.com/apuntesbach/bio2bach/01_biomoleculas/proteinas/proteinas2.htm
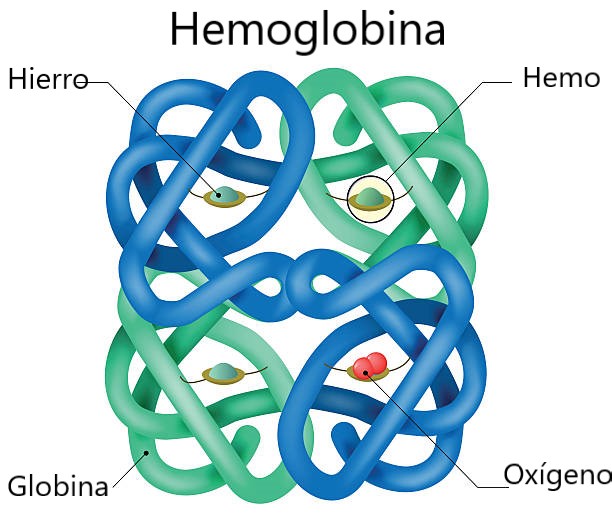
Un ejemplo típico de estructura cuaternaria lo presenta la Hemoglobina.
https://homomedicus.com/wp-content/uploads/2022/07/istockphoto-609084058-612x612-1.jpg
https://fmss12ucheme.wordpress.com/wp-content/uploads/2013/05/hemoglobinmolecule.gif
La posesión de proteínas específicas es un grave inconveniente en los trasplantes de órganos, pues el sistema inmune (¡no es demasiado listo!) del organismo receptor las "confunde" con agentes extraños y actúa en consecuencia... produciéndose el temido "rechazo".
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiHV2VckqF0tqlWo_uPHk66T_roqs0v8ljmcmUBMpWec6vOYGC0ZfiDNvEx-4bwi3hTNYUaXi87loJv8gIRnW__1L_g2aZnpbRaTvtj4b2XDDHkvFk1Dp0pe9svoORwlAYVVC0VFUZL2KI/s1600/Dibujo+1.jpg |
Las propiedades de las proteínas se ven alteradas a altas temperaturas o por adición de sustancias químicas. Cuando una proteína pierde su actividad se dice que se ha desnaturalizado.
https://labster-image-manager.s3.amazonaws.com/v2/PRD/8c2fc0e1-7746
-4ae8-a261-37206bc736de/PRD_Denaturation_definition.es_ES.png
Si añadimos ácido, o "lo hacen" determinados microorganismos (transforman la lactosa en ácido láctico) la leche "se corta" y la caseína (proteína de la leche), antes soluble, precipita (se solidifica)...
A temperaturas superiores a 60ºC, se coagula la ovoalbúmina (proteína de la clara de huevo).
https://cdn.cookmonkeys.es/recetas/medium/huevos-fritos.jpeg
¡¡¡¿¿¿Quién los pillara (o pillase) con un choricito y una patatas fritas???!!!







No hay comentarios:
Publicar un comentario